
近日,华南师范大学环境学院应光国教授团队抗生素耐药性研究小组乔路凯、何良英、高方舟、白红等人在环境领域期刊Water Research上发表了题为“Deciphering key traits and dissemination of antibiotic resistance genes and degradation genes in pharmaceutical wastewater receiving environments”的研究论文(DOI: 10.1016/j.watres.2025.123241)。
图摘要
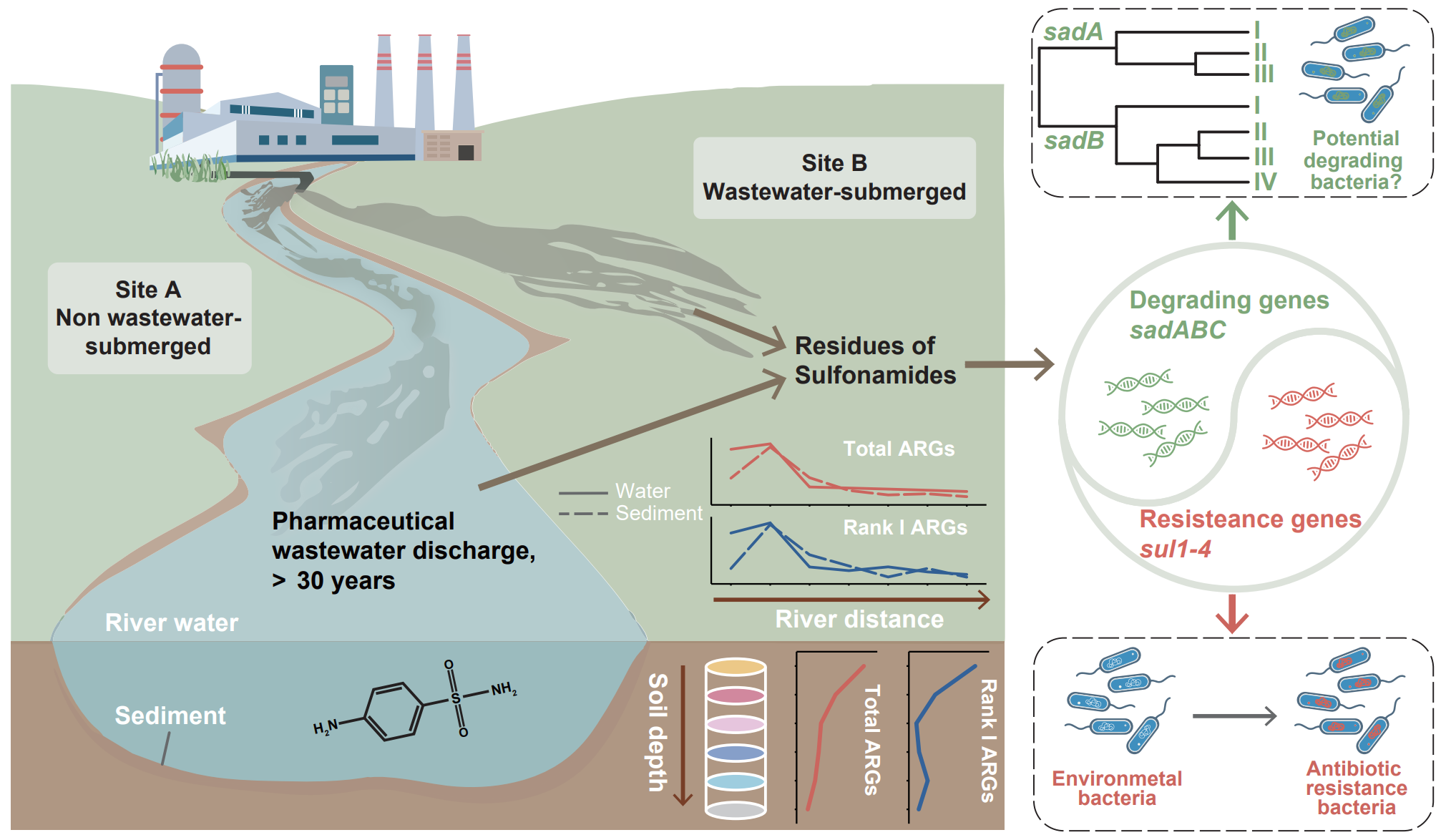
全文速览
引言
制药厂是环境中抗菌素耐药性(AMR)的重要来源。制药废水中超过一半的抗菌药物无法通过传统的废水策略进行去除,从而通过排放进入到环境中,并诱导ARGs和ARB的出现和增殖。磺胺类药物是最常用的抗生素之一。相比于其它环境介质,制药废水中的磺胺类药物残留浓度最高,浓度可达mg/L。磺胺类药物因其具有水解稳定性、半衰期长等特点,经常在各类制药废水受纳环境中被检测到。同时,残留的抗生素可以通过废水排放输送到下游河流,并经灌溉等过程迁移到深层土壤甚至地下水中。然而,目前关于ARGs和ARB沿纳污河流的水平迁移以及在纳污土壤中的垂直迁移仍存在一定的研究空白。
目前对磺胺类药物的耐药机制有两种:(i)抗生素靶位点的改变(即sul1-4)和(ii)磺胺类药物的酶促降解。后者不仅代表了一种耐药机制,也代表了一种可以减少环境中磺胺类药物残留的清洁策略。迄今为止,sadABC基因簇是唯一经过实验验证的磺胺类降解基因簇。降解过程包括sadA编码的单加氧酶催化磺酰胺的初始ipso-羟基化,然后是与sadB相关的后续转化,而sadC在两步反应中主要起辅助作用。Sad基因此前仅在Microbacteriaceae和Micrococcaceae的细菌分离株中被报道。然而,一些其它的细菌也被报道具有磺胺类药物降解能力,这意味着环境中可能仍存在待发现的sad基因宿主。由于大多数细菌是不可被培养的,因此宏基因组测序在鉴定未知的sad基因宿主方面具有重要价值。
本研究旨在探索制药废水受纳环境中抗生素抗性组和磺胺降解基因/细菌的传播。我们采用宏基因组学方法全面分析了总抗性组、高风险ARGs、多重耐药菌和致病菌的丰度和多样性,以揭示制药废水排放对受纳河流和土壤环境中AMR的影响。此外,我们还对sad基因进行了宿主预测和系统发育分析,以探索潜在的磺胺降解菌及其环境进化。这项研究的结果为评估与制药废水排放相关的AMR风险以及磺胺类药物污染的生物修复提供了重要启示。
主要结果
1. 制药废水受纳环境中的抗性组水平较高。在本研究的样品中共检测到1030种ARG亚型,属于28种ARG类型。其中磺胺类抗性基因sul1、sul2和多重耐药类抗性基因qacedelta1是最主要的ARGs。沿河流流向,水体和沉积物中的ARGs总丰度和丰富度从制药厂附近至最远端显著降低。值得注意的是,纳污河流中所有样品点的河水和沉积物的抗性组丰度均高于自然水体和沉积物的全球中位数水平,并且大部分高于污水处理厂出水的全球中位数水平,这意味着纳污河流的抗性组水平即便经过水体稀释作用仍然较高。制药废水显著改变了土壤的抗性组组成,ARGs总丰度和丰富度显著增加,6种ARG类型在纳污土壤中被显著富集,尤其是磺胺类抗性基因,总丰度增加了约22倍。纳污土壤的抗性组总丰度均高于自然土壤的全球中位数水平,而未被浸没的土壤样品均低于全球基线进一步强调了制药废水对土壤的影响。
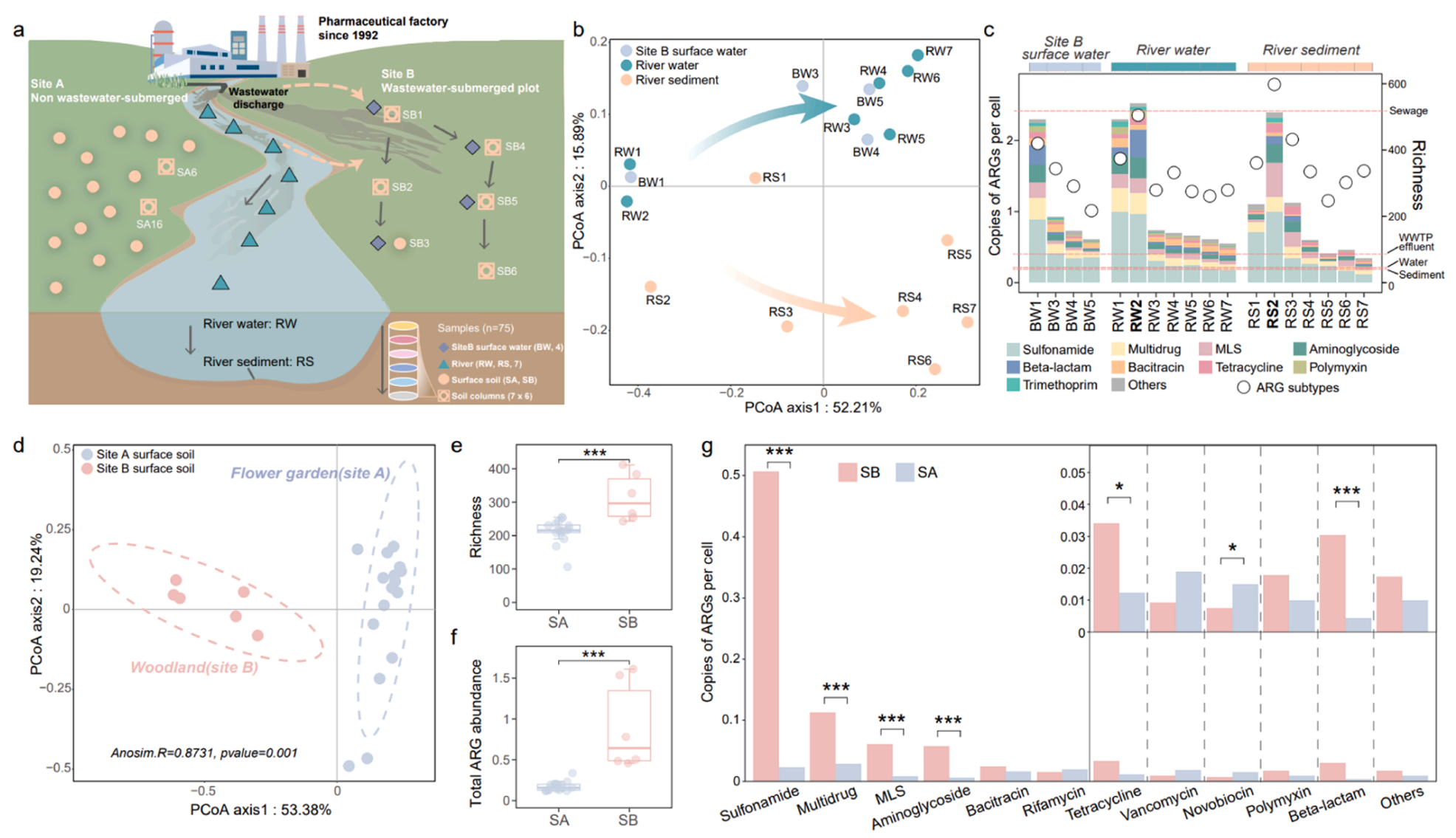
图1.纳污河流和土壤中的抗生素抗性组。(a)本研究的采样图。(b)纳污河流的PCoA分析。(c)纳污河流样品总抗性组的丰度和丰富度。(d)地表土的PCoA分析。(e-f)两个地表土区域总抗性组的丰度和丰富度。(g)两个地表土区域中不同ARG类型的总丰度。
2. 纳污土壤的抗性组总丰度和丰富度随深度显著降低。在不同深度的土壤样品中共检测到800种ARG亚型,属于27种ARG类型,其中磺胺类抗性基因(47.2%)和多重耐药类抗性基因(14.5%)是最主要的ARG类型。土壤的抗性组组成沿深度发生了显著的变化,总丰度和丰富度均显著下降。例如,最深层土壤中磺胺类抗性基因的丰度仅为地表土中的14.43%。值得注意的是,在20-40cm的深度,丰富度已经显著降低,且大多数样品的抗性组总丰度已经低于自然土壤的全球中位数水平。从地表土到20-40cm深度,抗性组总丰度平均降低了63.68%,丰富度平均降低了40.14%。
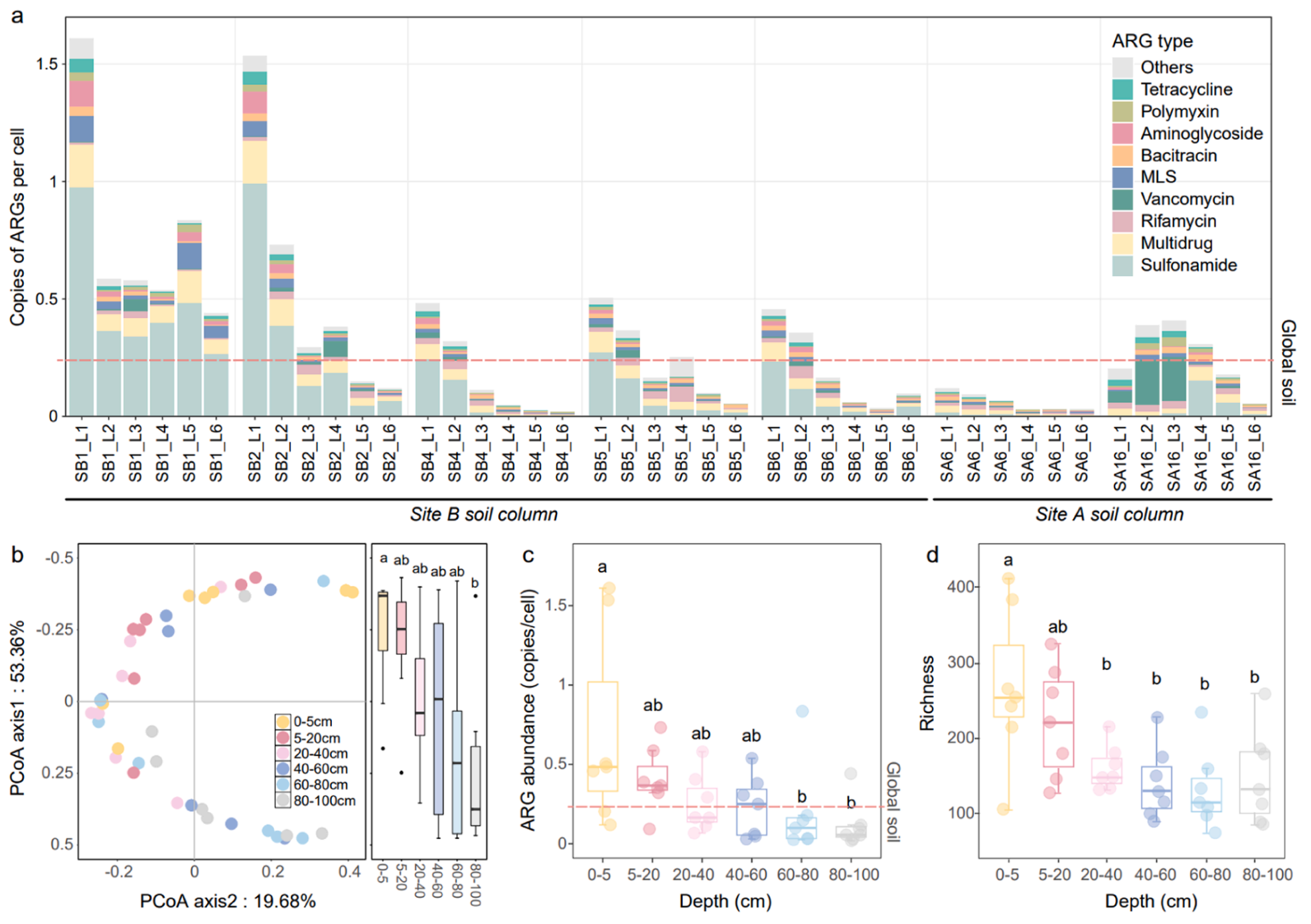
图2.纳污环境中不同土壤深度的抗生素抗性组。(a)不同土壤柱样品的抗性组分布特征。(b)PCoA分析。(c)不同土壤深度的总抗性组丰度。(d)不同土壤深度的抗性基因丰富度。
3. Rank I ARGs的检出突出了纳污环境中的AMR风险。在河水、沉积物和土壤中分别检出了61、71和59种risk rank I ARGs。与总抗性组的变化相似,rank I ARGs的总丰度沿河流和土壤垂直梯度均有所下降,最终可以降低约一个数量级。值得注意的是,所有河流样品中的rank I ARGs总丰度均远高于全球污水处理厂出水的中位数水平,而深层土壤中的总丰度仍与污水处理厂出水丰度相当。21、25和21种rank I ARGs分别在河水、沉积物和土壤中持续存在。其中17种ARGs在所有环境介质中均被检测到, sul1的含量最为丰富,占rank I ARG总丰度的43.63%。
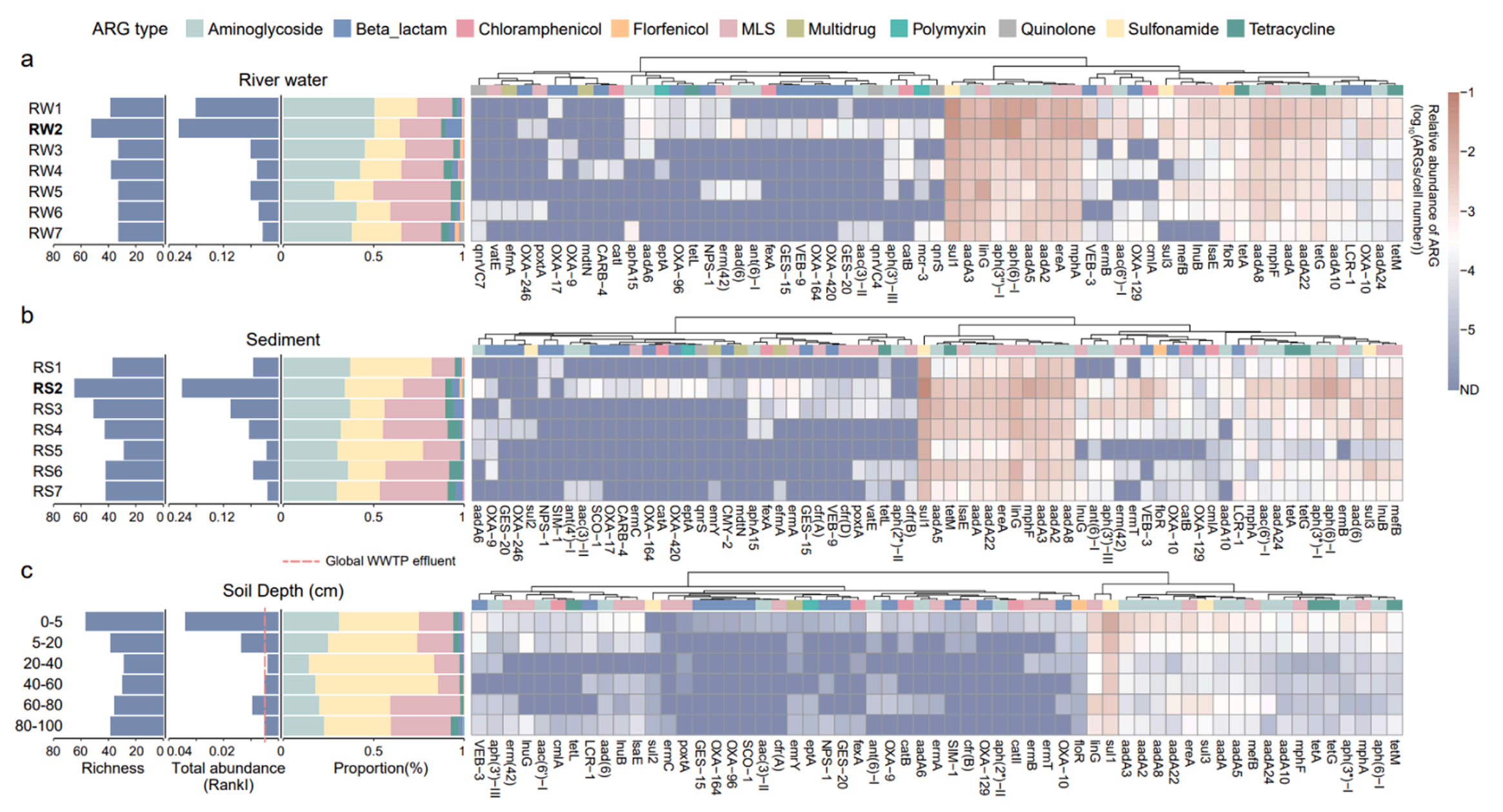
图3.制药废水受纳环境中的risk rank I ARG。河水(a)、沉积物(b)和不同土壤深度(c)样品中risk rank I ARGs的丰富度、总丰度、组成特征。
4. 制药废水受纳环境中潜在的多重耐药菌和致病菌。从所有样本中共组装到了2150个MAGs,其中有340个基因组携带了ARGs,携带的ARGs主要属于多重耐药类、万古霉素类。有113个MAG携带了至少两个ARGs。此外,我们鉴定到了17个潜在致病菌,尽管它们仅是ARG宿主的一小部分,但携带了大量的ARGs(17个MAGs携带了73个ARGs),其中47.06%的MAGs对多个药物具有耐药性。值得注意的是,ARB的总丰度沿河流并没有显著降低,尽管约一半的多重耐药菌和致病菌的丰度随河流呈下降趋势,但Mycobacteriaceae和Burkholderiaceae的某些MAGs在河流中持续存在。土壤中ARB的丰度和丰富度可以随着土壤深度的增加而显著降低,其中属于放线菌门和变形菌门的ARB丰度降低幅度较大,而一些未培养的多重耐药MAGs(例如:Nitrospirota、Patescibacteria的MAGs)在深层土壤中反而含量更高。
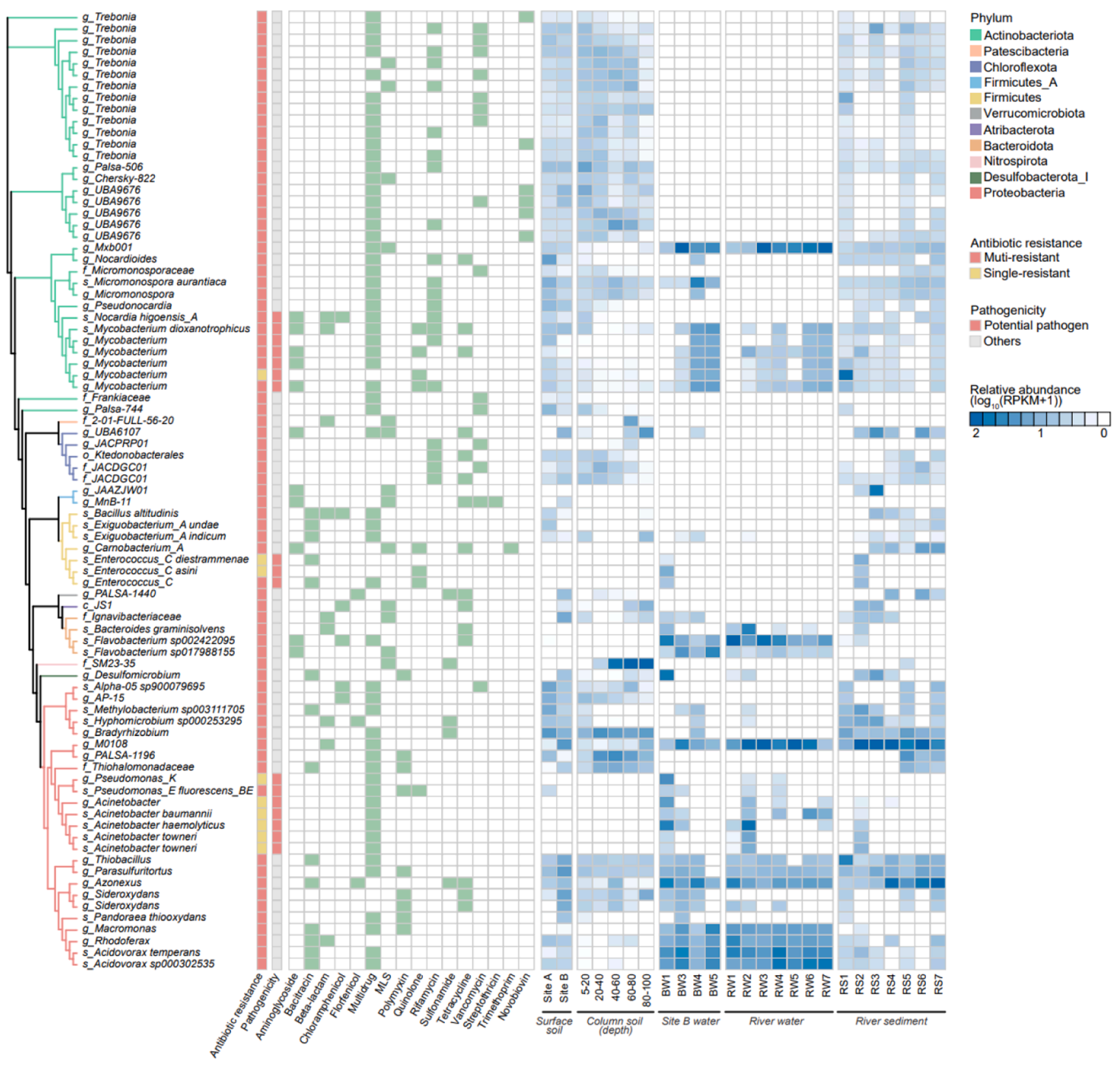
图4.多重耐药菌和潜在致病菌的分类组成、抗性组成和相对丰度。
5. 制药废水受纳环境中潜在的磺胺降解菌。从本研究的所有样本中共鉴定到了73条携带sadABC的contigs,其中76.71%的潜在宿主为Microbacteriaceae(sadA:32/35,sadB:23/37,sadC:1/1)。根据序列相似性,将本研究中的sad序列与从NCBI数据库获得的sad序列进行了聚类分析。sadA基因序列被划分为三个聚类(同一聚类相似度大于91.77%),本研究中获得的sadA序列均被划分为sadA Type I和Type III。物种组成方面,sadA Type II和Type III分别在Micrococcaceae和Microbacteriaceae被发现,而sadA Type I还在其它细菌科中被发现。隶属于其它细菌科的三条sadA序列与隶属于Microbacteriaceae的sadA Type I序列具有高度相似性,这意味着它们可能起源于一个共同祖先。而sadB基因序列被划分为四个聚类(相似度大于83.75%),序列可变性高于sadA。本研究中获得的sadB基因序列被划分至sadB Type I-III。物种组成方面,sadB Type II-IV序列的潜在宿主主要为Micrococcaceae和Microbacteriaceae,而sadB Type I有近一半的序列在其他细菌科中被鉴定到,例如Actinomycetaceae、Mycobacteriaceae和Micromonosporaceae。在基因组水平共鉴定到了四个含有sad基因的MAGs,隶属于Microbacteriaceae的MAG仅仅在部分样品中被检出,而隶属于Propionibacteriaceae的MAG广泛分布于纳污河流和纳污土壤中,体现了该MAG的生态位优势。值得注意的是,隶属于Mycobacteriaceae的MAG不仅具有致病性,同时携带了sad基因和多个ARG,其在河流中的传播可能会进一步加剧AMR风险。
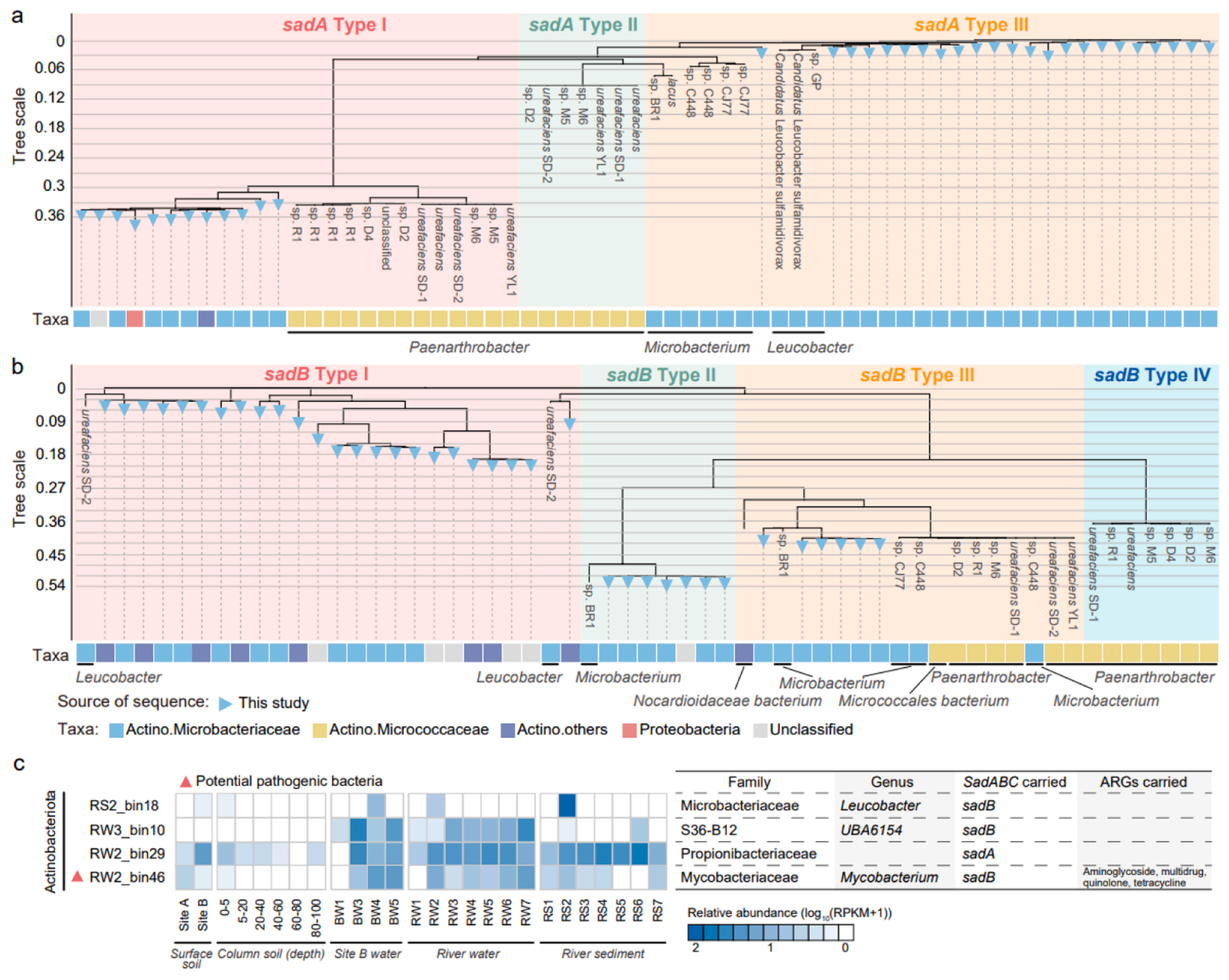
图5. sad基因的系统发育和潜在细菌宿主。基于本研究和NCBI数据库中sadA(a)和sadB(b)氨基酸序列的系统发育树分析。(c)携带了sad基因的MAG的相对丰度和抗性风险
结论
本研究揭示了ARGs和ARB在制药废水受纳环境中的持久性,并探讨了sad基因在这些环境中的进化与传播特征。我们发现纳污土壤中ARGs的丰度和多样性显著增加,纳污河流中抗性组水平持续高于全球抗性组基线,强调了制药废水对受纳环境的显著影响。高风险ARGs与多重耐药致病菌的持续存在突出了纳污土壤和河流环境中的耐药性风险。此外,sadA基因与sadB基因的系统发育特征突出了环境中sad基因的进化发育,以及新潜在宿主菌(可能隶属于Propionibacteriaceae和Mycobacteriaceae科)的出现。总体而言,本研究为制药废水受纳环境中抗生素抗性组的持久性和传播规律提供了新的见解,并强调了抗生素酶降解功能基因在这些环境中的富集。
致谢
本研究得到了国家重点研发计划(2020YFC1806901),国家自然科学基金(NSFC 42030703、42177226和U22A20604)的支持。同时感谢广东省化学污染与环境安全重点实验室(2019B030301008)的支持。
全文引用: Qiao, L.-K., He, L.-Y., Gao, F.-Z., Huang, Z., Bai, H., Wang, Y.-C., Shi, Y.-J., Liu, Y.-S., Zhao, J.-L., Ying, G.-G., 2025. Deciphering key traits and dissemination of antibiotic resistance genes and degradation genes in pharmaceutical wastewater receiving environments. Water Research 275, 123241.